CORRIENTE ELÉCTRICA EN LOS LÍQUIDOS
Cuando hablamos de conductores eléctricos nos referimos, habitualmente, a los hilos de cobre, puesto que, en el proceso de transporte de la corriente, se utilizan conductores de este tipo. Sin embargo, sabemos que los metales, en general, son buenos conductores, y también comprobamos como la humedad puede transformar en conductores cuerpos considerados como aislantes. Analicemos el comportamiento de los líquidos y sustancias disueltas frente a la corriente eléctrica.
Electrólitos
La estructura de un buen número de sustancias sólidas se mantiene debido al equilibrio entre conjunto de las fuerzas electrostáticas (atractivas y repulsivas) que existen entre los iones de que están formadas. Estas cargas mantiene en su posición y el cuerpo aparece eléctricamente neutro. Si lo conectamos entre dos puntos de un circuito, no circulará la corriente.
Para dotar de movilidad a estas cargas, debe desaparecer la estructura de sólido y, por lo tanto, romperse las uniones entre iones. Sí aumentamos su temperatura, se llegará al punto de fusión, y así, las cargas del cuerpo, ahora líquido, gozarán de libertad de movimiento. Del mismo modo, si disolvemos en un líquido adecuado una porción de sólido, los iones procedentes de éste estarán libres para desplazarse por el interior del disolvente. Los cuerpos que realizan estos procesos de producción de cargas libres en los líquidos se denominan electrólitos y, además de los compuestos iónicos, pueden ser ácidos, sales, hidróxidos...
Conducción en los líquidos
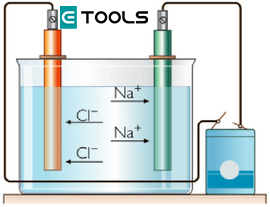
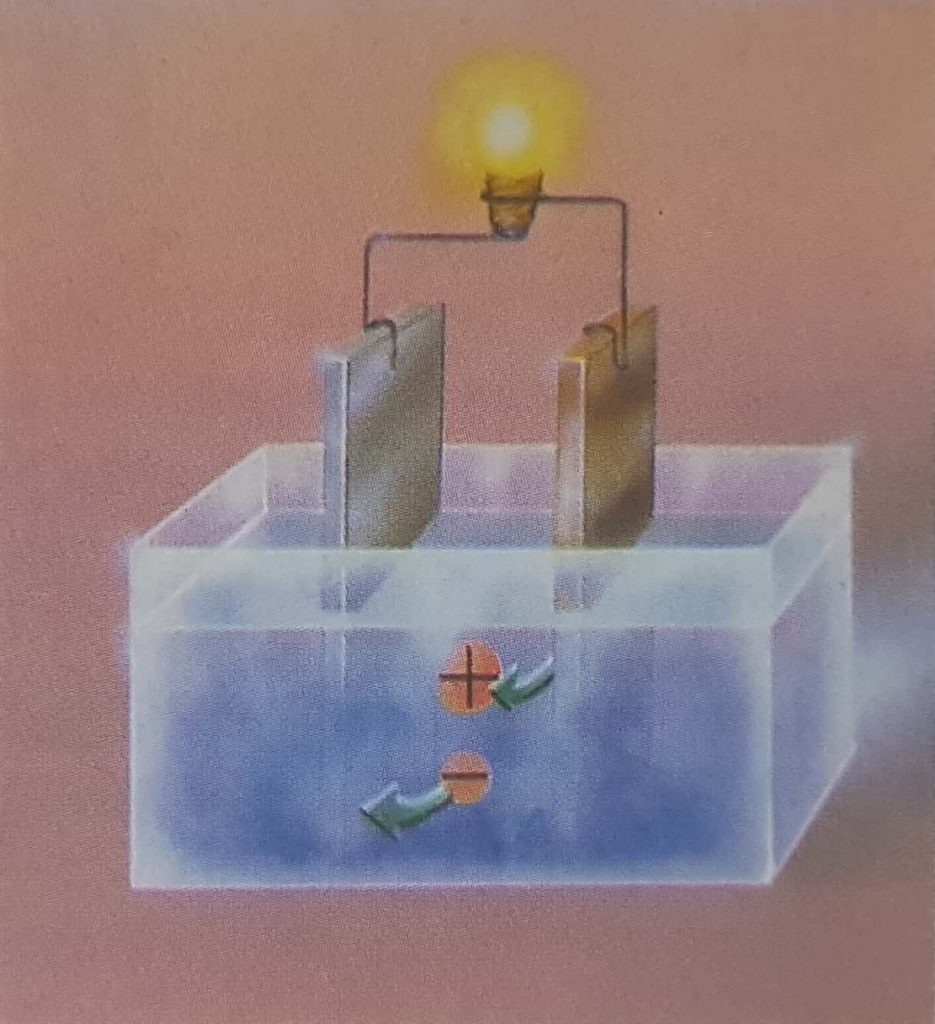
Un campo eléctrico establecido en una solución electrolítica actuará sobre las cargas libres y producirá un desplazamiento conjunto de ellas, de manera que podemos detectar el paso de corriente a través del líquido. Los electrodos utilizados en una cuba eléctrica se llaman ánodo (+) y cátodo (-), y deben ser químicamente inactivos; los más usados son hilos de platino.
Una vez establecido el campo, los iones con carga negativa se desplazarán lentamente hacia el ánodo, debido a lo cual se denominan aniones. Los iones con carga positiva (cationes) se dirigirán en sentido contrario, es decir, hacia el cátodo. Se producirá, pues, una doble corriente, que podremos detectar en el circuito exterior.
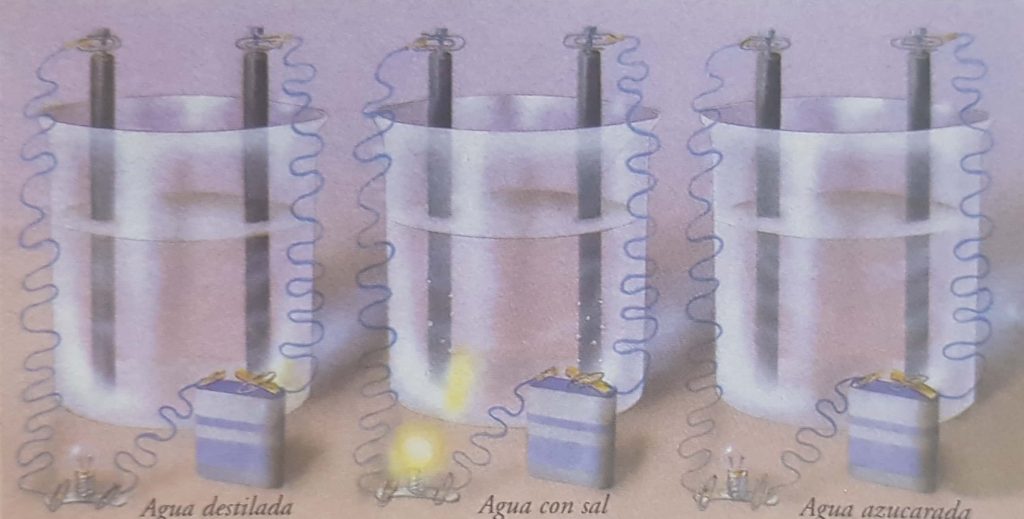
El agua destilada está disociada débilmente y, por ello, no contiene suficiente iones para que se produzca un paso apreciable de corriente. Al disolver en ella un electrolito (sal) se evidencia corriente en el circuito exterior. Si la sustancia disuelta (azúcar) no se disocia, sigue sin conducir.
A menudo, cuando un catión llega al cátodo, recibe de este uno o más electrones procedentes del circuito exterior, mientras que los aniones pueden ceder al ánodo aquellos electrones que le sobran para quedar eléctricamente neutros.
Ya en 1833, Michael Faraday observó que el agua pura es aisladora, pero no lo son las disoluciones de ciertas sustancias en agua. Si dos electrodos conectados a los bornes de un generador de corriente continua se introducen en un vaso con agua destilada, no apreciaremos paso de corriente. Bastará con disolver pequeñas cantidades de sal o de ácido sulfúrico para que tengamos oportunidad de observar cierta intensidad de corriente eléctrica.
El fenómeno de la conducción de la corriente eléctrica por un líquido recibe el nombre de electrólisis y va acompañado por ciertos efectos químicos. Si el electrólito disuelto contiene cationes metálicos, se puede producir una deposición de metal en el cátodo, usando electrodos adecuados.
En el caso del agua acidulada (con unas pocas gotas de un ácido) aparecerán unas burbujas de gas alrededor de los electrodos de platino. Se trata de hidrógeno (en el cátodo) y de oxígeno (en el ánodo) que, al ser gases, se deberán recoger sobre agua en unos tubos de ensayo invertidos
En la electrólisis del agua acidulada se desprende el doble de volumen de hidrógeno en el cátodo que de oxígeno en el ánodo. La reacción química tiene lugar al consumirse la energía eléctrica suministrada por el generador.
Pila electroquímica
Un dispositivo parecido, pero de funcionamiento inverso, es la pila voltaica. Dos electrodos de materiales diferentes, colocados en dos puntos de un electrolito adecuado, pueden interactuar químicamente con el líquido o las sustancias en él disueltas, de manera que se produzca una corriente que, a través de ellos, pueden circular por un circuito externo. Cada uno de los electrodos químicamente activos realiza un intercambio de iones y electrones con la solución, y el sentido de la corriente externa depende del sentido y las velocidades respectivas con que hagan dicho intercambio.
En la pila Daniell (un ejemplo sencillo), los electrodos de zinc y cobre están, respectivamente, en disoluciones, comunicadas entre sí, de sulfato de zinc y sulfato de cobre. El zinc extrae los electrones de la disolución hacia el exterior en tanto que el cobre los introduce.
Los acumuladores de plomo (las baterías) tienen un comportamiento similar, y el funcionamiento de las pilas habitualmente utilizadas también se basa en el mismo fenómeno.
En la pila electroquímica, las semirreacciones que se producen en los electrodos generan una energía eléctrica que pueden ser utilizable en el circuito exterior.
¡Si te gustó el artículo no dudes en dejarnos un comentario!

Deja un comentario