
DILATACIÓN: CAMBIOS DE ESTADO

Los efectos producidos sobre un cuerpo al comunicarle calor son: o el aumento de su temperatura, o un cambio en su estado físico. Estudiaremos a continuación la dilatación de los cuerpos al aumentar su temperatura.
Dilatación
En las grandes construcciones metálicas es preciso prever unas juntas de dilataciones para evitar los problemas derivados de las variaciones térmicas (imagen). Cuando se calientan un globo, una pelota o un recipiente lleno de gas, se hinchan y aumentan su presión interior.
Sabemos que la temperatura es una medida de la energía cinética media de las partículas que forman el cuerpo. Un sólido está formado por partículas fijas, ligadas a las que las rodean por ciertas fuerzas. Cada partícula vibra alrededor de su posición de equilibrio y, en su movimiento, afecta a las demás. Al aumentar la temperatura se acrecienta la amplitud de las vibraciones y, por lo tanto, crece la distancia entre las partículas por sus acciones mutuas y el cuerpo se dilata: sus dimensiones aumentan.
El incremento de la longitud de un cuerpo es proporcional a su longitud inicial. La dilatación es también proporcional al aumento de temperatura. Cada material tiene un coeficiente de dilatación lineal λ que equivale al aumento de la unidad de longitud cuando la temperatura sube un grado. Así, la longitud de un cuerpo a temperatura t será:
Donde l0 es la longitud a 0°C.
Al dilatarse un cuerpo aumentan todas sus dimensiones. Podremos, así, considerar el aumento de las superficies y del volumen, cuyas ecuaciones son semejantes a la anterior. Los correspondientes coeficientes de dilatación son muy aproximadamente múltiplos del lineal: 2λ para el superficial y 3λ para el de volumen.
Según la teoría cinética, las partículas de un fluido se mueven con entera libertad hasta que chocan elásticamente entre sí o con las paredes del recipiente, lo cual es la causa de la presión del fluido. Al aumentar la energía cinética de las partículas, crecen la violencia de los choques y la presión que el fluido ejerce sobre sus límites. Si alguno de ellos es desplazable, como, por ejemplo, la superficie libre de un líquido, un émbolo móvil, un tapón flojo o una pared elástica, aumenta el volumen.
En los líquidos, al no ser comprensibles, la dilatación se traduce sólo en un aumento de volumen y no de presión. Para saber el aumento real de volumen de un liquido que se dilata, hay que considerar, además, la dilatación que habrá sufrido la vasija.
Como al aumentar la temperatura de los gases pueden acrecentarse tanto su volumen como su presión, consideraremos separadamente el aumento de volumen V manteniendo la presión constante; y el aumento de la presión p, manteniendo constante el volumen. Si utilizamos ecuaciones parecidas a las de dilatación de los sólidos, nos aparecerán dos coeficientes de dilatación que tendrán el mismo valor, el cual, además, será idéntico para todos los gases. Sin embargo, es más útil emplear, para los gases, las leyes de Gay Lussac-Charles: a presión constante V/T = cte, y a volumen constante p/T = cte, donde T es la temperatura absoluta.
Se puede modificar el volumen de un gas sin calentarlo con solo modificar la presión. Según la ley de Boyle-Mariotte, a temperatura constante, el volumen de un gas es inversamente proporcional a su presión.
Si combinamos las tres leyes anteriores, obtendremos la llamada ley de los gases perfectos o ideales:
Que suelen presentarse en la forma de la ecuación de Clausius-Clapeyron:
Donde n es la cantidad de gas en moles y R la constante universal de los gases cuyo valor en el SI es de 8,3 J/K mol.
Estas ecuaciones se cumplen de forma muy aproximada solo si el gas está lejos de condiciones extremas.
Cambios de estado
Como sabemos, una sustancia de composición química definida se presenta en estados o fases (solido, liquido, gas, etc.), diferentes según sus características termodinámicas ( p y T). Al cambiar de estado, varía la estructura de la sustancia, a la vez que se produce un consumo o una liberación de energía. Mientras tiene lugar el cambio de estado no varía la temperatura, puesto que toda la energía se emplea en vencer algunas de las fuerzas que mantenían unidas entre sí las partículas del cuerpo o en crear otras ataduras entre ellas. La temperatura del cambio de estado de sustancias puras es propia y características de cada cambio para una presión determinada.
¿Qué te pareció este artículo? ¡No olvides dejarnos tu comentario aquí abajo ante cualquier consulta!
Si quieres conocer otros artículos parecidos a DILATACIÓN: CAMBIOS DE ESTADO puedes visitar la categoría Fisica.

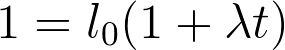
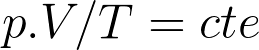





Deja un comentario