
DEFINICIÓN DE CALOR - QUE ES, SIGNIFICADO Y CONCEPTO
¿QUE ES EL CALOR?
Nunca te preguntaste, por que cuando nos frotamos las manos notamos que se calientan?, esto tiene una explicación y hay que abordarla desde el punto de vista físico, básicamente lo que ocurre es que la energía mecánica del movimiento de nuestras manos se transformó en energía térmica.
Si prendemos leña para un asado, por el hecho de quemar la madera la energía química se transforma en energía térmica. Lo mismo sucede si tocamos una bombilla de luz que está encendida: la notamos caliente; aquí la energía eléctrica se transformó en energía térmica.
Durante muchos siglos, los científicos estuvieron preocupados por la naturaleza del calor y hubo muchas polémicas al respecto. Las primeras evidencias de que el calor es una forma de energía fueron presentadas por el conde Benjamin Thompson Rumford en Alemania durante el siglo XVIII. Ya en el siglo XIX, las investigaciones llevadas a cabo por el físico inglés James Joule, por nuestro conocido Lord Kelvin y por Rudolf Celsius, otro físico pero alemán, condujeron a una teoría moderna sobre el calor, a la que podemos expresar como:
El calor es energía transferida de un cuerpo a otro como consecuencia de la diferencia de temperatura.
Aunque es cierto que el calor es una forma de energía, es energía en tránsito.
Al calor, de ahora en más, lo designaremos con la letra Q.
LAS UNIDADES DE CALOR
El calor se puede medir como pérdida o como ganancia de energía; efectivamente, se mide como cualquier forma de energía (la unidad es el joule). Pero hay otras unidades que también son utilizadas.
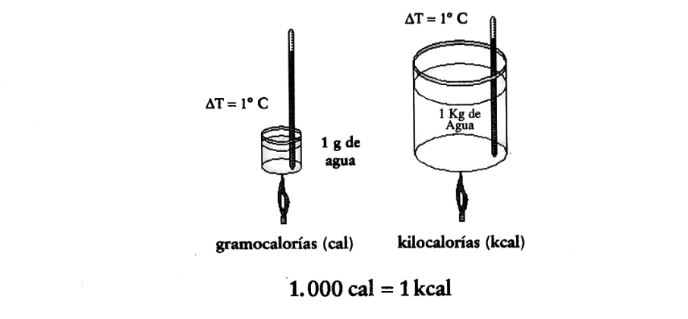
La más usada es la caloría (cal), a la que podemos definir como la cantidad de energía para elevar 1 g de agua en 1° C. Otra unidad a la que estamos muy acostumbrados cuando hablamos de las dietas es la kilocaloría (kcal), que es la energía necesaria para elevar 1 kg de agua en 1° C.
Como dato curioso, en algunos países como Australia o Alemania, las bebidas dietéticas se rotulan en unidades habituales de energía "menos de 4 kjoules (1 kcal en 0,35 L)".
LA CAPACIDAD CALORÍFICA
Si colocamos sobre el fuego dos cacerolas, una con 1 L de agua y otra con 2 L de agua, ¿cuál de ellas aumenta primero en 1° C su temperatura? ¿Cuál se enfría antes?
Si llamamos ∆Q1 a la cantidad de calor recibida por 1 L de agua y ∆Q2 a la cantidad de calor recibida por 2 L de agua, sabemos que ∆Q1 < ∆Q2
También sabemos que si tenemos 1 kg de vidrio y 1 kg de hierro, se necesitan diferentes cantidades de calor para elevar en 1° C la temperatura, lo cual nos lleva a la conclusión de que cuerpos diferentes necesitan diferentes cantidades de calor para elevar su temperatura en 1° C. Esto se llama capacidad calorífica (C) de un cuerpo, que se define como:
Donde ∆Q es la cantidad de calor y ∆T es la variación de temperatura.
Atención: la capacidad calorífica NO es la cantidad de calor que un cuerpo pue-de retener.
EL CALOR ESPECÍFICO
En el verano, si caminamos sobre la arena, la sentimos más caliente que el agua del más. Lo mismo sucede cuando tocamos un vidrio y lo sentimos más frío que el marco de la ventana, que es de madera. Estas distintas sensaciones que nos producen distintos materiales que reciben la misma cantidad de calor en el mismo tiempo dependen de la naturaleza de los materiales; entonces, si les damos la misma cantidad de calor a diferentes sustancias, la temperatura cambia de manera diferente.
Dicho de otro modo, se necesitan diferentes cantidades de calor para elevar en 1° C la temperatura de 1 g de masa. A esta cantidad diferente de calor la llamamos calor específico y la designamos con la letra c:
Y como:
Si reemplazamos:
La palabra "específico" se utiliza porque se refiere a las características de una sustancia.
Las unidades de c son cal/g° C. Cuanto mayor es el calor específico, mayor será la cantidad de energía que se le debe transferir para cambiar su temperatura.
El agua tiene un gran calor específico; hay alimentos con gran contenido de agua: por ejemplo, si sacamos una papa o una cebolla de una cacerola donde se cocina un puchero, es más fácil que nos quememos la lengua con la cebolla que con la papa, pues tiene más contenido de agua y demora más en enfriarse. Es posible que esto les haya sucedido a ustedes comiendo una pizza, el tomate o el queso tienen mayor calor específico que la masa. Así que... ¡cuidado!
Al calor específico del agua, por definición, le damos el valor de 1 cal/g° C.
EL INTERCAMBIO DE CALOR
Cuando tocamos un vidrio, nuestra mano se enfría y el vidrio se calienta: se produce un fenómeno denominado intercambio de calor. Si tenemos un sistema térmicamente aislado, por el principio de la conservación de la energía, la cantidad total de calor intercambiada es cero.
Si quieres conocer otros artículos parecidos a DEFINICIÓN DE CALOR - QUE ES, SIGNIFICADO Y CONCEPTO puedes visitar la categoría Fisica.
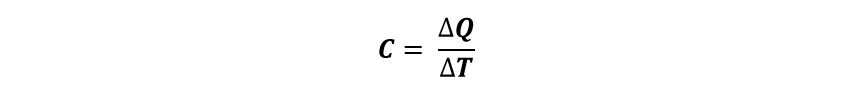
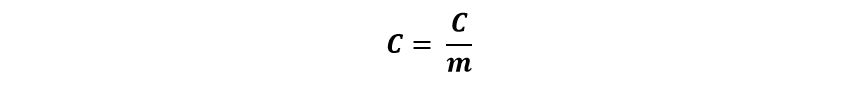
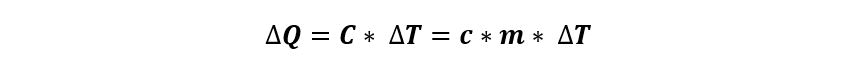





Deja un comentario