¿QUE ES UN GAS? - DEFINICIÓN - CONCEPTO Y SIGNIFICADO

¿QUE ES UN GAS?
Si alguna ves te preguntaste ¿que es un gas?, es bueno saber que la palabra “gas” fue inventada durante el siglo durante el siglo XVII por el médico y químico belga Jan Baptista Van Helmont para designar uno de los estados de la materia, el estado gaseoso.
Van Helmont descubrió que el humo es distinto del aire, del vapor del agua y de la existencia de otros gases que debían ser identificados.
Fueron muchos los científicos que desde entonces investigaron los gases. Dos de los más destacados son el inglés Joseph Priestley y el francés Antoine-Laurent Lavoisier; este último es considerado el padre de la química moderna.
Priestley y Lavoisier descubrieron que las plantas eliminan oxígeno cuando son iluminadas por la luz del Sol, lo que ayuda a la vida en nuestro planeta. Hoy en día sabemos otras cosas de los gases, como:
- Pueden existir regiones del espacio y se puede lograr experimentalmente que el gas no esté presente; esto se llama vacío.
- Los gases de clorofluorcarbono (que vienen de los aerosoles, de la refrigeración o de los embalajes plásticos) son contaminantes atmosféricos que destruyen la capa de ozono.
- El ozono es un gas muy beneficioso para el planeta cuando está a grandes alturas porque actúa como un escudo protector y es muy perjudicial cuando está a bajas alturas.
- La fermentación de la materia orgánica producto de la descomposición de los residuos domésticos produce, a su vez, gas metano (que forma las burbujitas que vemos salir a veces del fondo de los ríos y los lagos), que se está investigando como combustible alternativo al petróleo.
- El color de algunas piedras preciosas se debe a la presencia de gas en sus partículas.
LAS TRANSFORMACIONES DE UN GAS
En un gas no hay fuerzas que mantengan unidas a las moléculas; por eso, estas se mueven de manera muy desordenada.
- Un gas sufre una transformación de estado cuando se modifican por lo menos dos de las variables que definen su estado. Las variables de estado son la presión p, el volumen V y la temperatura T. Podemos decir que:
- Si T se mantiene constante y varían la presión y el volumen, tenemos una transformación isotérmica ("iso" quiere decir "igual").
- Si p se mantiene constante y varían la temperatura y el volumen, tenemos una transformación isobárica.
- Si V se mantiene constante y varían la presión y la temperatura, tenemos una transformación isomérica o isocórica.
En una transformación isotérmica, la presión y el volumen están relacionados por la ley de Boyle-Mariotte:
Esta ley se llama así por el químico ingles Robert Boyle y por el físico francés Edmé Mariotte.
Establece que si la temperatura pertenece constante, la presión es inversamente proporcional al volumen que contiene al gas.
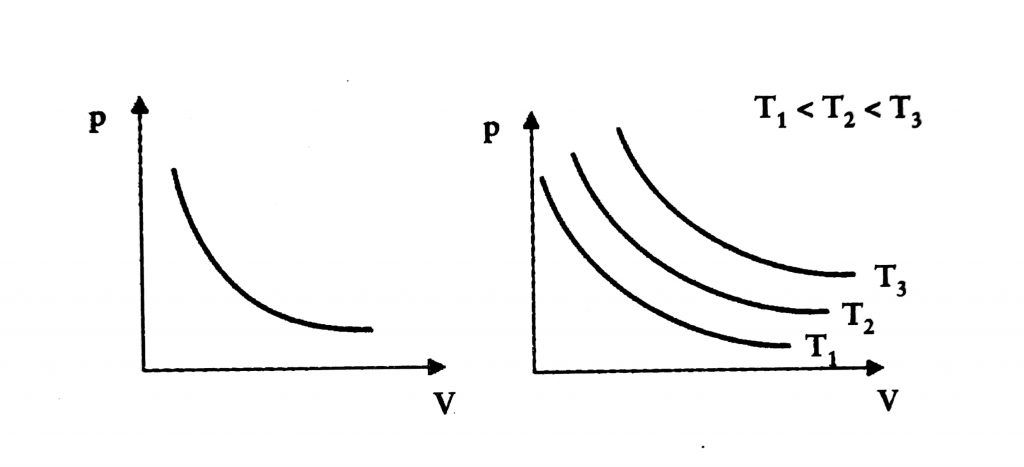
Si hacemos la representación gráfica de una transformación isotérmica, la curva que la representa es una hipérbola que llamamos isoterma, y si cambiamos la temperatura, tendremos varias hipérbolas, cada una representando otra temperatura constante.
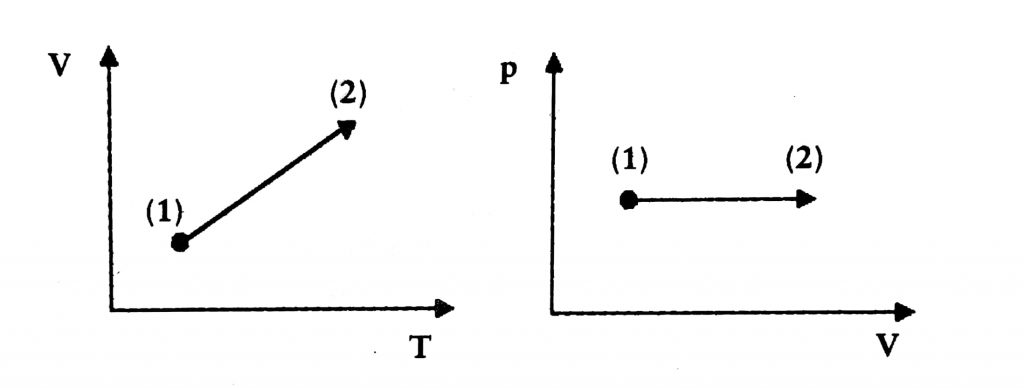
Las primeras experiencias hechas por el matemático y físico francés Jacques Charles para volar en globos donde el aire interior se calentaba lo llevaron a interesarse por las relaciones entre el volumen y la temperatura de un gas y le permitieron llegar a una ley que relaciona de manera inversamente proporcional el volumen y la temperatura. Posteriormente, el físico-químico francés Joseph-Louis Gay Lussac de modo independiente llegó a la misma conclusión; esta se conoce como ley de Charles-Gay Lussac para transformaciones isobáricas:
Las representaciones gráficas a presión constante en los diagramas (V, T) o en (p, V) son:
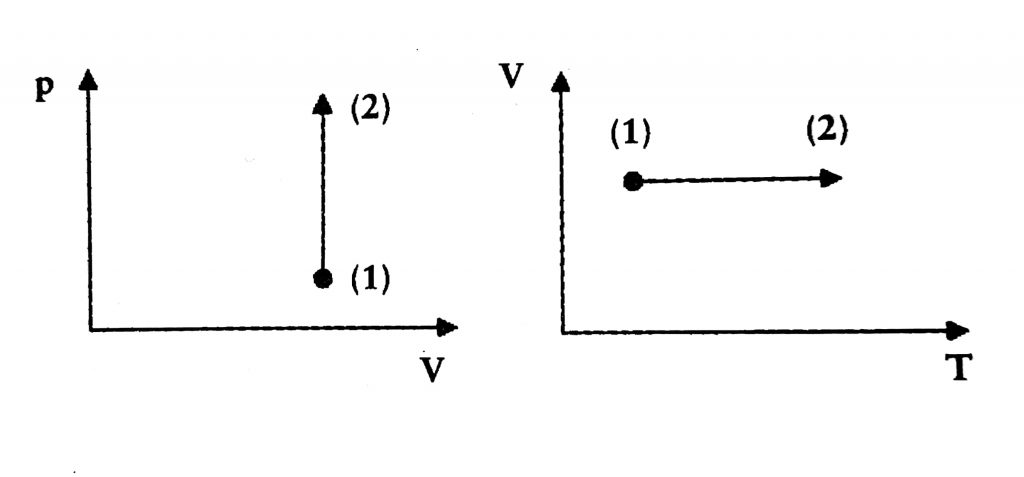
El motor de un automóvil, una heladera o una locomotora funcionan porque hay transformaciones del gas a volumen constante. La relación entre la presión p y la temperatura T a volumen V constante también fue descubierta por Jacques Charles y Joseph-Louis Gay Lussac.
Ellos establecieron que cuando se produce una transformación de un gas a volumen constante la presión varía inversamente proporcional a la temperatura, es decir:
Las representaciones gráficas de las transformaciones isoméricas en los diagramas (p, V) y (V, T) son:
LOS GASES IDEALES
Los gases ideales son gases cuyas moléculas no interactúan entre sí y cuyas partículas se consideran puntuales. Solamente existen en la teoría y deben cumplir la ley de Boyle-Mariotte y las leyes de Charles-Gay Lussac. Pero hay gases de muy baja intensidad que asimismo cumplen estas tres leyes. Es decir:
Pero también:
Cumple las tres leyes; llamamos a esta ecuación “ecuación de los gases ideales”:
También la podemos escribir como:
Dónde N es el número total de moéculas de gas y k es la constante de Boltzmann que vale k=1,38 * 10-23 J/K.
En el siguiente artículo hablaremos sobre qué es el calor, la capacidad calorífica y el calor específico.
Esperamos que te haya gustado este artículo, te esperamos en el siguiente y no olvides dejarnos tu comentario!
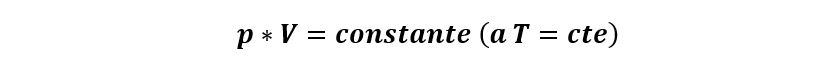
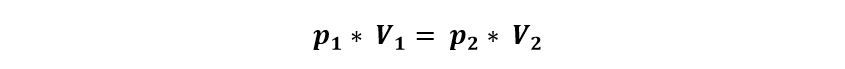
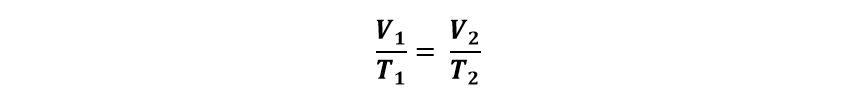
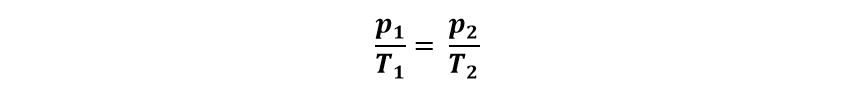
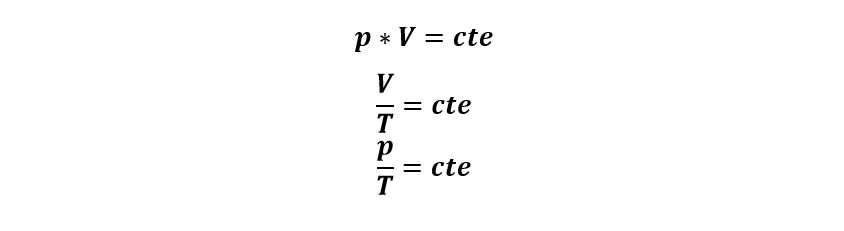
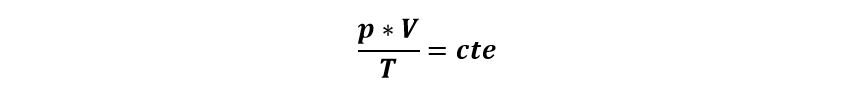
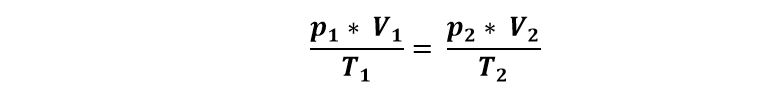
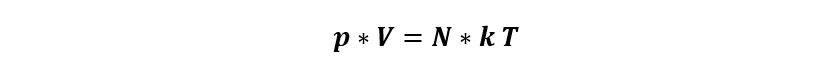
Deja un comentario