TERMODINÁMICA – CONSERVACIÓN DE LA ENERGÍA

TERMODINÁMICA
La termodinámica trata las leyes que rigen la trasformación de energía en un sistema, incluyendo naturalmente, el calor como forma de energía. Estas leyes fueron descubiertas y expresadas matemáticamente hacia mediados del siglo XIX. La termodinámica comprende los procesos térmicos, mecánicos, eléctricos y químicos.
PRINCIPIO CERO
Colocando dos cuerpos a distinta temperatura aislados térmicamente de la influencia de otros cuerpos, el más caliente se enfría y el más frío se calienta hasta alcanzar el equilibrio térmico, permaneciendo en ese estado. Decimos entonces que ambos cuerpos se encuentran en iguales estados térmicos.
Este resultado se conoce como principio cero de la termodinámica.
PRINCIPIO DE EQUIVALENCIA
La experiencia de Joule permitió comprobar que si un trabajo mecánico W se transforma adiabáticamente en calor Q, la relación W/Q = J es una constante universal que solo depende del sistema de unidades y se denomina equivalente mecánico del calor. De la relación anterior resuelta:
PRIMER PRINCIPIO DE LA TERMODINÁMICA.
PRINCIPIO DE LA CONSERVACIÓN DE LA ENERGÍA.
Llamamos pared adiabática a la que aísla térmicamente del exterior.
Trabajo adiabático es el realizado sobre un sistema que no gana ni pierde calor, es decir, el sistema está contenido entre paredes adiabática.
El trabajo adiabático depende solamente del estado inicial y final del sistema y lo expresamos como una función U llamada energía interna del sistema.
Si el sistema recorre un ciclo cerrado, vuelve al estado inicial, la ecuación anterior podemos expresarla:
Adoptamos una convención de signos:
Tomamos positivo al calor Q absorbido por el sistema y el positivo al trabajo W realizado por las fuerzas del medio exterior sobre el sistema.
Si el sistema pasa de un estado A a otro B, la variación de la energía interna del sistema será:
Que expresa el trabajo adiabático realizado sobre el sistema. Entonces:
Por lo antedicho el principio de conservación de la energía podemos expresarlo de las siguientes maneras:
- En todo sistema aislado la energía total del sistema permanece constante, por lo que para las diversas transformaciones de la energía, la suma total de ellas, en todas sus formas, permanece constante.
- En todo sistema al que se le entrega energía, incluyendo el calor absorbido o el trabajo realizado sobre el sistema, y que no cede energía al exterior, la energía entregada es igual a la variación de la energía interna en todas sus formas.
Cuando solamente intervienen calor y energía mecánica, el principio de conservación de la energía se conoce como primer principio de la termodinámica.
Por lo expuesto es imposible construir una máquina térmica que después de recorrer un ciclo cerrado produzca como único efecto la realización de un trabajo exterior. En otras palabras, no es posible el movimiento perpetuo.
Una máquina de este tipo se denomina móvil perpetuo de primera especie.
En el siguiente artículo hablaremos sobre el segundo principio de termodinámica, la irreversibilidad.
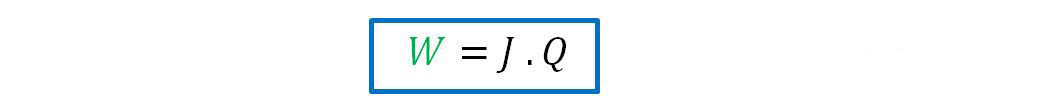
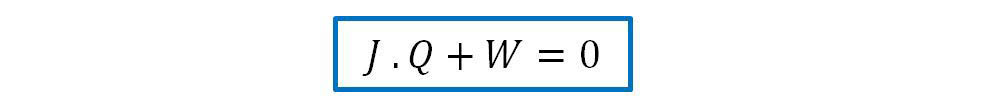
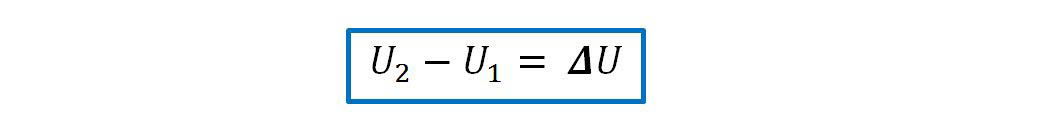
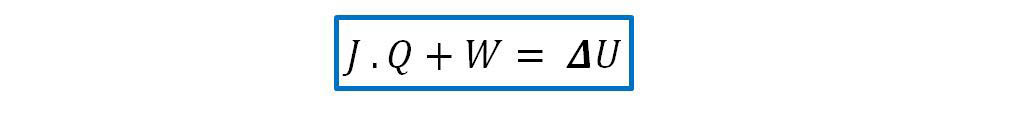

Deja un comentario