El enlace covalente. Sus clases

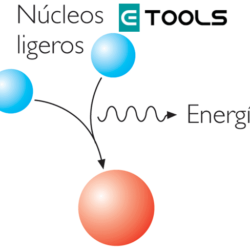
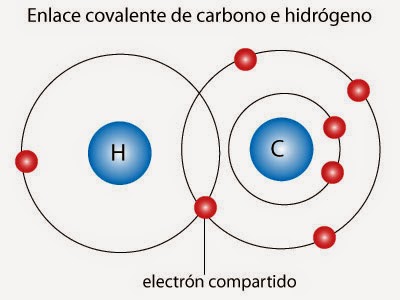
No siempre es posible, entre átomos, una transferencia de electrones tan obvia como en el caso de los compuestos iónicos, pues únicamente se efectúa entre elementos de muy distinta electronegatividad. ¿Cómo explicarse, por ejemplo, el enlace en la molécula de cloro, que es diatómica, si ambos átomos tienen la misma electronegatividad? ¿Dónde radica la fuerza de enlace? Gilbert Newton Lewis (1875-1946) profesor en la universidad de California, pudo responder estas preguntas proponiendo el modelo siguiente: Si consideramos que el cloro tiende a poseer la configuración electrónica de gas noble, podemos pensar que se produce la transferencia de un electrón de un átomo a otro, de forma recíproca, compartiendo ambos estas cargas. Los electrones del enlace se encuentran, la mayor parte del tiempo, en el espacio que separa los dos núcleos, formándose, por consiguiente, una nube de carga negativa entre ellos. La fuerza de enlace queda justificada porque los núcleos positivos se hallan atraídos por esta nube interatómica negativa. Este tipo de enlace recibe el nombre de covalente y es el más habitual en los compuestos químicos.
Polaridad en los enlaces
En el ejemplo anterior, los electrones se hallan compartidos por igual y la molécula no experimenta polarización. En cambio, existen moléculas formadas por enlaces covalentes entre átomos de distinta electronegatividad, donde se produce cierta separación de cargas porque el átomo más electronegativo atrae con más fuerza los electrones del enlace. Se obtiene una molécula polar. El grado de polaridad de una molécula se conoce con el nombre de momento dipolar.
Enlace covalente coordinado o dativo
Sucede, con bastante frecuencia, que los electrones del enlace, aun siendo compartidos por dos átomos, únicamente son aportados por uno de ellos. Este tipo de enlace covalente se conoce con el nombre de coordinado o dativo.
Enlaces covalentes múltiples
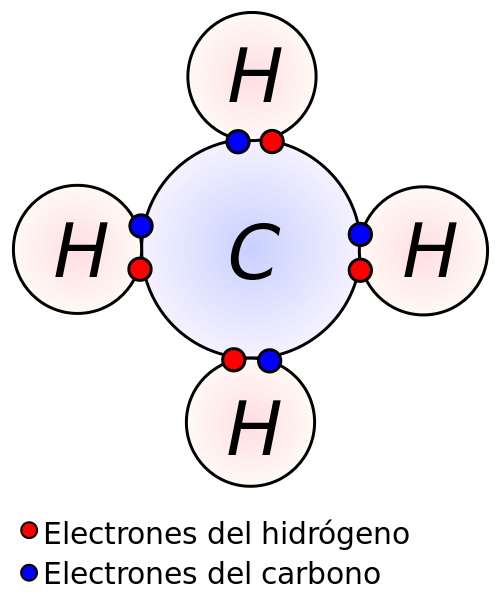
Entre dos átomos pueden compartirse más de un par de electrones, con lo que se obtiene un enlace covalente múltiple. Si se comparten dos pares de electrones se dice que están unidos por un enlace covalente doble. Si están ligados con tres pares de electrones, se trata de un enlace covalente triple.
Resonancia
Existen moléculas poliatómicas a las que no es posible asignarles una única estructura electrónica. Se pueden representar mediante varias notaciones sin que ninguna de ellas justifique, de forma satisfactoria, las propiedades observadas experimentalmente. Se conoce con el nombre de resonancia al estado que representa una fórmula intermedia entre todas las posibles. La representación de ese estado intermedio se llama híbrido de resonancia.
Propiedades de las sustancias covalentes
- 1. Al ser dirigido y localizado entre los átomos, el enlace es muy fuerte, por lo que las moléculas son las mismas en cualquier estado, sólido o gaseoso.
- 2. Si las moléculas no son polares, la atracción entre ellas es débil, y por ello estas sustancias son gases o líquidos a temperatura ambiente. Únicamente serán sólidas si sus moléculas constan de numerosos átomos.
- 3. No son conductoras del calor ni de la electricidad debido a que los electrones sólo tienen movilidad en el enlace.
- 4. Generalmente son solubles en disolventes no polares.
- 5. Los puntos de ebullición de las sustancias covalentes son mucho menores que los de las de enlace iónico. En ocasiones, como en el caso del diamante o del cuarzo, los átomos forman cristales atómicos que resultan tener una dureza y un punto de fusión muy elevados.
Consideraciones finales
Los enlaces covalente e iónico no se dan, generalmente, en forma pura, como se ha explicado. Los compuestos jónicos se caracterizan porque sus iones, al encontrarse muy próximos, se atraen mutuamente por fuerzas eléctricas y se produce cierta compartición de electrones que asigna al enlace un relativo carácter covalente. Al propio tiempo, las sustancias covalentes polares adquieren un cierto carácter iónico al producirse un desplazamiento de la carga eléctrica en el enlace. Por tanto, podemos decir que la mayor parte de las sustancias tienen un porcentaje de carácter iónico y otro covalente en función de la electronegatividad que posean sus átomos. Si bien estas consideraciones responden numerosas cuestiones, quedan algunas sin resolver. Existe la teoría del orbital molecular, mucho más general, que salva esta dificultad; pero su estudio corresponde a un nivel superior.
¡Si te gustó el artículo no dudes en dejar tu comentario aquí abajo!
Si quieres conocer otros artículos parecidos a El enlace covalente. Sus clases puedes visitar la categoría Quimica.



Deja un comentario