Leyes ponderales de la combinación química
Hasta la segunda mitad del siglo XVIII, los «químicos» se dedicaban a obtener reacciones químicas, que anotaban y describían con sumo cuidado. Dibujaban los aparatos que utilizaban y explicaban detalladamente las técnicas experimentales. Los tratados resultaban muy curiosos, incluso interesantes, pero estaban desprovistos de leyes que permitieran un estudio organizado de los procesos químicos.
Antoine Laurent Lavoisier -que nació en París en 1743 y murió guillotinado en una plaza pública de su ciudad natal el 8 de mayo de 1794, en la época del Terror que se produjo durante la Revolución Francesa-, fue quien puso fin a esta falta de sistematización. Impuso el método científico a su trabajo, con lo que contribuyó, de forma notable, al nacimiento de la química como ciencia.
Ley de la conservación de la masa
La aportación de Lavoisier se debe al empleo de la balanza como instrumento fundamental en su trabajo. Demostró, de forma irrefutable, que «en una transformación química, la suma de las masas de las sustancias que reaccionan (reactantes) es la misma que la de las obtenidas (productos)».
Algunos «químicos» anteriores a Lavoisier ya la habían utilizado como hipótesis de trabajo, pero fue él quien la demostró y quien la supo generalizar y difundir.
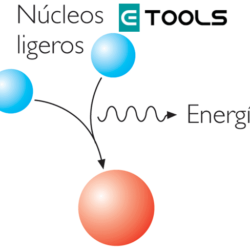
En 1916, Albert Einstein (1879-1955) publicó su Teoría General de la Relatividad, donde aparece la ecuación E = m.c2; E representa la energía, m la masa y c la velocidad de la luz, que es una constante. De esta sencilla ecuación se deduce algo fantástico: la masa y la energía son de la misma esencia, es decir, la masa se puede transformar en energía y la energía en masa, como se observa en los procesos atómicos. Así pues, la ley de la conservación de la masa no es rigurosamente exacta, pues en las reacciones químicas siempre se pone de manifiesto una determinada cantidad de energía y, por consiguiente, se produce una variación de la masa en el proceso. Sin embargo, en la práctica, la energía puesta en juego en la reacción química es equivalente a una cantidad de masa totalmente inapreciable, por lo que sigue siendo válida la ley de Lavoisier, si exceptuamos los procesos nucleares.
Una sencilla experiencia permite comprobar la ley de la conservación de la masa: se pesa un tubo de ensayo con una solución transparente de nitrato de plomo. El tubo dispone de un tapón colocado de manera que queden aislados, entre éste y una gasa, unos cristales de yoduro potásico. Se obtiene el mismo peso que cuando al invertir el tubo se pone en contacto la solución con el sólido. Aparece un precipitado de color amarillo, debido a la obtención de yoduro de plomo en la reacción espontánea que se produce.
Ley de Proust o de las proporciones definidas
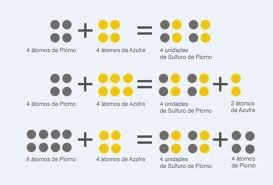
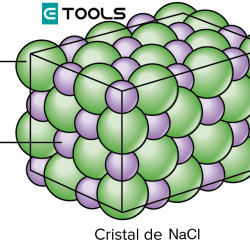
El químico francés Louis Joseph Proust (1754-1826), siguiendo la técnica de Lavoisier de cuantificar mediante pesadas las reacciones químicas, demostró en 1801 que «cuando varios elementos se combinan para formar un determinado compuesto, lo hacen en una relación de pesos fija».
Ley de Dalton o de las proporciones múltiples
John Dalton (1766-1844), profesor de química y física en Manchester, enunció en el año 1803 la ley que lleva su nombre: «Las cantidades variables de un mismo elemento que se combinan con una cantidad fija de otro para formar dos o más compuestos distintos, se encuentran en una relación numérica sencilla».
Ley de Richter o de las proporciones recíprocas
Jeremías Benjamín Richter (17621807), químico alemán, descubridor del elemento metálico indio, no enunció personalmente la ley de las proporciones recíprocas, pero se le atribuye la frase «Dios ordenó todo según peso y medida», lo cual demuestra que siguió fielmente el método científico señalado por Lavoisier. Es considerado el fundador de la Estequiometría, que estudia las relaciones, en peso y volumen, existentes entre las sustancias que intervienen en una reacción química. Sólo expuso un caso particular de la ley de las proporciones recíprocas, pero con el mérito de ser anterior a la ley de Dalton, cuyo enunciado es como sigue: «Si dos elementos A y B reaccionan con una misma cantidad de otro C, al reaccionar entre sí los dos primeros lo harán en las mismas cantidades con que reaccionaron con C o en múltiplos sencillos de aquéllas».
¡Si te gustó el artículo no dudes en dejar tu comentario aquí abajo!
Si quieres conocer otros artículos parecidos a Leyes ponderales de la combinación química puedes visitar la categoría Quimica.




Deja un comentario