Generalidades. Enlaces Iónico
Estudiada la composición del átomo, cabe preguntarse: ¿cómo y por qué se unen los átomos para formar moléculas?, ¿por qué la molécula de hidrógeno es diatómica y la de ozono triatómica?, ¿por qué motivo los gases nobles y los metales en estado de vapor están constituidos por átomos aislados?, ¿a qué se debe que el fluoruro sódico, fundido o en solución, sea conductor de la electricidad...? Para contestar éstas y otras muchas preguntas, es necesario plantear un modelo de enlace que esté de acuerdo con los resultados experimentales.
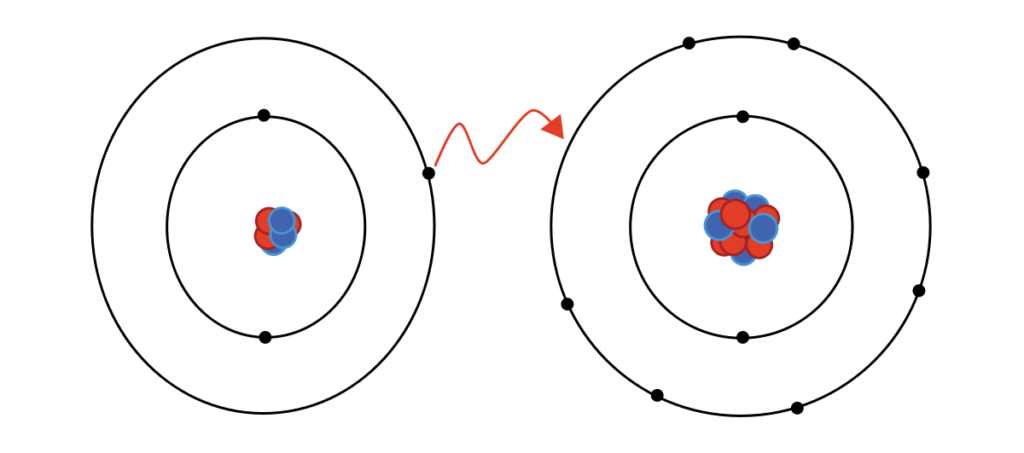
La atracción que se produce entre los átomos que se unen se llama enlace químico. La fuerza que mantiene estable dicha unión, llamada fuerza de enlace, es de naturaleza eléctrica. Una explicación del enlace radica en suponer que los átomos, provistos de una corteza formada por electrones que giran alrededor de un núcleo diminuto, pueden colisionar con suficiente energía para que se realice una transferencia de electrones entre ellos que rompa su neutralidad eléctrica y origine la correspondiente atracción eléctrica que los mantendrá unidos.
De este modo se consigue que la suma de los contenidos energéticos de cada átomo sea inferior a la suma de los contenidos energéticos de estos átomos aislados. Prueba de ello es el desprendimiento de energía que se observa cuando se forma un compuesto a partir de sus elementos. Esta energía es la misma que hay que suministrar para romper los enlaces (energía de enlace).
Cuando se produce esta unión, tanto los núcleos como sus respectivas capas electrónicas quedan afectados de alguna manera. Resulta lógico que sea así, porque al aumentar o disminuir el número de cargas eléctricas se produce, en cada átomo, una variación de su volumen que afecta a toda la corteza y, necesariamente, al núcleo positivo. Ahora bien, lo más importante para comprender el enlace químico son los electrones que intervienen, electrones de valencia, que proceden de la última capa, llamada capa de valencia, y tienden a adquirir la configuración de gas noble, mucho más estable.
Enlace iónico o electrovalente
Consideremos, por ejemplo, la notación electrónica del átomo de cloro: 1s2 2s2 2p6 3s2 3p5; se observa que le falta un electrón para adquirir la estructura del argón: 1s2 2s2 2p6 3s2 3p6. El halógeno tenderá a captar esa carga para adquirir la configuración de gas noble. En cambio, el átomo de sodio, por ejemplo, con notación 1s2 2s2 2p6 3s1, puede ceder, con relativa facilidad, el electrón solitario de su tercer nivel y transformarse en un ion positivo con la estructura del neón: 1s2 2s2 2p6.
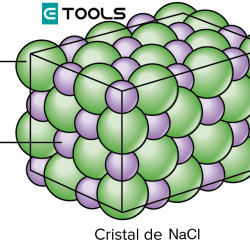
Así se comprende que el sodio y el cloro reaccionen violentamente, porque se producen iones cloro y sodio —muy estables— que se orientan en el espacio de manera que compensan las atracciones y repulsiones eléctricas, formando un cristal iónico. El número de electrones que gana o pierde un átomo para transformarse en ion se llama valencia iónica o electrovalencia. Así, las valencias del cloro y del sodio son -1 y +1, respectivamente. Estos compuestos no forman moléculas individuales, pero sin embargo se les asigna una fórmula representativa, que en el ejemplo es NaCl (cloruro de sodio).

Propiedades generales de los compuestos iónicos
- Son sólidos de elevados puntos de fusión y ebullición, si los comparamos con los compuestos orgánicos.
- En estado fundido o en disolución, son buenos conductores de la corriente eléctrica.
- Son frágiles.
- No se disuelven en disolventes no polares, pero son muy solubles en disolventes polares.
¡Si te gustó el artículo no dudes en dejar tu comentario aquí abajo!
Si quieres conocer otros artículos parecidos a Generalidades. Enlaces Iónico puedes visitar la categoría Quimica.



Deja un comentario