Espectros atómicos
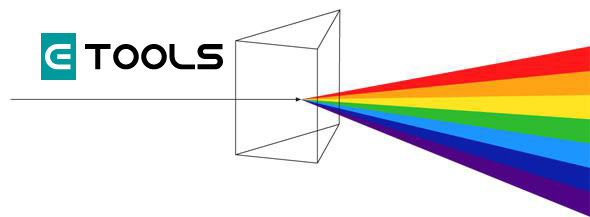
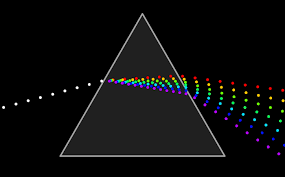
En 1666, Isaac Newton (1642-1727) observó que cuando un haz de luz blanca atraviesa un prisma óptico se obtiene una banda continua de colores consecutivos, ordenados del siguiente modo: rojo, naranja, amarillo, verde, azul, añil y violeta. Demostró que la luz blanca no era más que una combinación de dichos colores. A este conjunto de radiaciones luminosas lo llamó espectro.
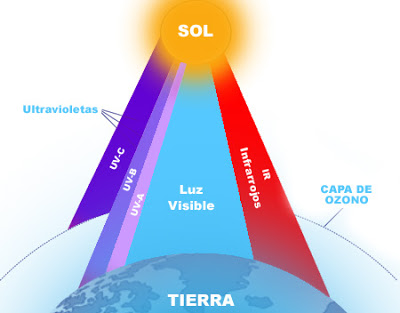
En el año 1800, el astrónomo anglogermano William Herschel (1792-1871) descubrió que un termómetro se calentaba al colocarlo en la zona oscura más allá del color rojo. Este hecho se atribuyó a la existencia de un tipo de radiación invisible, a la que se llamó infrarroja. En 1801, William Hyde Wollaston (1766-1828) y Johann Wilhelm Ritter (1776-1810) observaron que, en la zona del espectro invisible ubicada más allá de la franja del color violeta, el cloruro de plata se ennegrecía rápidamente. Se descubrió, de este modo, la existencia de una radiación invisible a la que se llamó ultravioleta.
En 1914, Joseph von Fraunhofer (1787-1826), óptico alemán, descubrió que el espectro solar está cruzado por numerosas franjas oscuras (rayas de Fraunhofer), cuya naturaleza desconocía.
En 1857, el químico Robert Wilhelm von Bunsen (1811-1899) perfeccionó y divulgó un mechero, que anteriormente había usadp Faraday. Se comprobó que, al colocar una sustancia en la llama se producían coloraciones distintas segun fuera la naturaleza del cuerpo que se empleara.
En 1860, Bunsen y su colaborador Gustav Robert Kirchhoff (1824-1887) idearon un aparato para estudiar los espectros de las sustancias incandescentes, el espectroscopio. Descubrieron que, cuando un elemento se quema en la llama del mechero Bunsen, aparecen unas rayas brillantes y coloreadas en su espectro visible. Los espectros obtenidos por sustancias incandescentes, sin que intervenga ninguna sustancia absorbente, se llaman de emisión. Pueden ser continuos, como el logrado con el arco eléctrico o con un filamento incandescente de una lámpara eléctrica, o discontinuos, como es el caso del obtenido con elementos a baja presión y en las condiciones adecuadas. Los espectros de emisión de gases pueden estudiarse cómodamente utilizando un tubo de Geissler.
Kirchhoff observó que cada elemento tenía su espectro de emisión característico, como sí de una huella digital se tratara, y ello le llevó al descubrimiento de dos nuevos elementos, el cesio y el rubidio. Kirchhoff se dio cuenta de que las dos abigarradas líneas correspondientes al espectro de emisión del sodio se encontraban en la misma posición que dos de las líneas oscuras de Fraunhofer. Con el objeto de que la línea oscura fuera neutralizada por una brillante, consiguió que la luz del sodio y la solar pasaran juntas por una ranura. Se sorprendió al comprobar que las líneas oscuras se oscurecían más aún. Concluyó que, cuando la luz pasa por un gas, éste absorbe las longitudes de onda que emitiría en estado de incandescencia. Si el Sol poseía las líneas del sodio ennegrecidas significaba que la luz solar pasaba por vapor de sodio en su viaje hacia la Tierra, de lo cual se concluía que debía de existir vapor de este metal en la atmósfera del Sol. Los espectros que se obtienen a partir de las radiaciones que, procedentes de un foco emisor, han atravesado una determinada materia, se llaman espectros de absorción.
Espectros de rayos X
En 1912, Max Theodor Felix von Laue (1879-1960) demostró, al obtener un espectro de difracción utilizando un cristal -muy delgado- de sulfuro de cinc como red de difracción, que los rayos X eran ondas electromagnéticas de muy corta longitud de onda.
El físico angloaustraliano William Laurence Bragg, a partir del estudio de la difracción que experimentan los rayos X reflejados en la superficie de un cristal, obtuvo espectros, de fondo continuo, con rayas características del metal que constituye el anticátodo en un tubo de Coolidge. Estas rayas se presentan en series semejantes en todas las sustancias. Se les ha dado el nombre de K, L, M, N, etc., según el orden creciente de su longitud de onda. El año 1913, Henry Gwyn-Jeffreys Moseley (1887-1915) demostró que la raíz cuadrada de la frecuencia de la radiación primera (Ka) de cada serie emitida por un elemento que actúa de anticátodo es proporcional a su número atómico. Este descubrimiento permitió la determinación de los números atómicos de los elementos.
¡Si te gustó el artículo no dudes en dejar tu comentario aquí abajo!
Si quieres conocer otros artículos parecidos a Espectros atómicos puedes visitar la categoría Quimica.



Deja un comentario