▷ Masas atómicas relativas ▷ Hipótesis de Avogadro

Estudiadas las leyes ponderales de la combinación química, Dalton propuso asignar a cada elemento una masa relativa a la de otro, que se tomaría como unidad. Era preciso saber la proporción de átomos simples que formaban un átomo compuesto, por lo que formuló la teoría llamada «de la máxima simplicidad», consistente en suponer que en cualquier transformación química binaria los átomos se unían uno a uno si formaban un solo compuesto. Caso de ser posibles dos compuestos habría una combinación binaria, otra ternaria, etcétera. Así, supuso que un átomo de oxígeno se combinaba con uno de hidrógeno para formar un «átomo compuesto» de agua, cuya fórmula sería HO. Un ejemplo de la ley de Proust sería que 8,89 g de oxígeno reaccionaban con 1,11 g de hidrógeno; la relación es, por lo tanto:
1,11/8,89 ≈ 1/8. Resultaba que la masa del átomo de oxígeno era 8 veces mayor que la del hidrógeno.
Al considerar la masa del átomo de hidrógeno arbitrariamente como la unidad, se podía asignar una masa relativa al átomo de oxígeno igual a 8. Lamentablemente, este resultado (que no calculó con exactitud) fue erróneo, debido a la equivocada teoría de la máxima simplicidad -que sin duda provocó un retraso en el desarrollo de la química- Dalton no habría incurrido en este error si hubiera comprendido el alcance de las leyes volumétricas de Gay-Lussac, que no aceptó porque no obtuvo resultados concordantes al experimentarlas y porque sus conocimientos relativos a los gases impedían que estas leyes encajaran con su teoría atómica, que tan brillantemente justificaba, por otro lado, las leyes ponderales de la combinación química.
Hipótesis de Avogadro
Amedeo Avogadro (1776-1856), conde de Quaregna y profesor de física de la Universidad de Turín, encontró la forma de conciliar los resultados experimentales de Gay-Lussac con la teoría atómica de Dalton. En 1811 propuso que las partículas de los gases elementales no estaban formadas por átomos simples, sino por agregados de átomos a los que llamó moléculas, palabra que procede del latín moles y que significa «masa». Sugirió, además, que volúmenes iguales de gases diferentes medidos en las mismas condiciones de presión y temperatura, debían tener el mismo número de moléculas. AndréMaric Ampère (1775-1836), químico, físico y filósofo francés, llegó a plantear esta hipótesis en 1814, con independencia de Avogadro.
Los gases elementales están formados por moléculas generalmente diatómicas. Cuando se produce una reacción química se escinden, de manera que sus átomos quedan en libertad y se reagrupan para formar moléculas de compuesto. Estas ideas no fueron aceptadas por la comunidad científica, pues se pensaba que el enlace químico se producía, exclusivamente, por atracciones electrostáticas. Por tanto, resultaba difícil entender que átomos iguales, con la misma carga eléctrica, pudieran atraerse mutuamente para formar una molécula. Tampoco se entendía, aun admitiendo la existencia de moléculas de un elemento, la necesidad de que las mismas fueran diatómicas y no triatómicas o tetraatómicas…
Estas ideas resultaron demasiado avanzadas para su tiempo. Por ello tuvieron que transcurrir 47 años hasta que, en 1858, el químico italiano Stanislao Cannizzaro (1826-1910) explicara tanto su significado como trascendencia.
Cannizzaro, basándose en el principio de Avogadro, estableció un método para obtener masas moleculares relativas de compuestos gaseosos o fácilmente volátiles. De ellas era posible deducir, de manera coherente y con bastante exactitud, las masas atómicas de muchos elementos.
En 1818, Pierre Dulong (17851838) y Alexis Petit (1791-1820) determinaron las masas atómicas de los elementos que no forman compuestos fácilmente volátiles, como es el caso de los metales, hallando la siguiente ecuación empírica: Calor específico x Masa atómica = 6,3 cal • moll-1 •°C. Así se ponía fin a un período de confusión en el conocimiento de las masas atómicas, que había originado que cada químico de cierto renombre escribiera de manera particular, propia, las fórmulas de los compuestos.
Se tomó el oxígeno como base de pesos de combinación debido a que son muchos los elementos que se combinan directamente con él. En 1961, la Unión Internacional de Química Pura y Aplicada adoptó como unidad de masa atómica la doceava parte de la masa del átomo de carbono 12, para corregir de este modo una falta de criterio que se planteó al descubrirse los isótopos (del cual en otros capítulos estaremos desarrollando).
Al número que indica la masa atómica de un elemento o la molecular en un compuesto, expresada en gramos, se le llamó mol De la hipótesis de Avogadro, hoy ley, se deduce lo siguiente.
- Un mol de cualquier elemento tiene el mismo número de átomos, o de moléculas si se trata de un compuesto. Este número, conocido como número de Avogadro (N2), se ha podido determinar por varios métodos (en el apartado Electroquímica: Electrolisis se detalla uno de ellos), resultando ser 6,0235.1023 (602.350 trillones).
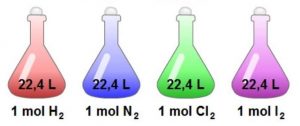
- Que el volumen que ocupa un mol de cualquier gas ideal a 0 °C de temperatura y 1 atmósfera de presión, condiciones llamadas normales, es 22,4 litros.
¡Si te gustó el artículo no dudes en dejar tu comentario aquí abajo! 🙂
Si quieres conocer otros artículos parecidos a ▷ Masas atómicas relativas ▷ Hipótesis de Avogadro puedes visitar la categoría Quimica.


Deja un comentario