Estructura atómica: el núcleo
En este artículo hablaremos sobre la estructura atómica, recomendamos leer ‘partículas elementales’ para complementar el tema.
Los fenómenos relativos a los rayos catódicos, canales y radiactivos ponían en evidencia que los átomos estaban constituidos por partículas cargadas eléctricamente. Dada la neutralidad del aromo, cabía preguntarse como se encontraban dispuestas en el mismo.
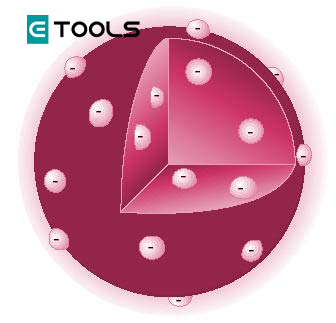
En 1910, Thomson, con el objeto de obtener más información sobre la distribución de las cargas eléctricas en el interior del átomo, irradió con partículas α una finísima lámina de oro (qué, al igual que la plata, el aluminio o el cobre, pueden laminarse en espesores del orden de 10-6 cm). Al atravesar el metal, sufrían pequeñas desviaciones respecto a su dirección original, puestas de manifiesto mediante una placa fotográfica. Interpretó el resultado sugiriendo que estas insignificantes desviaciones eran debidas a que las partículas positivas hablan sufrido un pequeño cambio en su trayecto por la existencia de cargas de signo opuesto, los electrones, los cuales debían de encontrarse uniformemente distribuidos en el interior del átomo. Propuso que el átomo podía considerarse como una pequeña esfera de electricidad positiva, dada la elevada masa de los protones, en la que se encontraban incrustados los electrones, de masa insignificante y con carga negativa, en número suficiente para neutralizar la carga positiva.

Modelo atómico de Rutherford
En 1911, Hans Geiger y Ernest Masada, colaboradores de Rutherford, repitieron la experiencia con el objeto de reproducir los resultados experimenta. de Thomson.
Observaron que la mayoría de las partículas atravesaban el metal experimentando pequeñas desviaciones en su trayectoria —como había indicado Thomson—, pero se sorprendieron al ver que mientras algunas sufrían fuertes desviaciones, otras rebotaban en el metal y volvían hacia atrás, lo cual significaba que habían chocado con un obstáculo extraordinariamente denso.
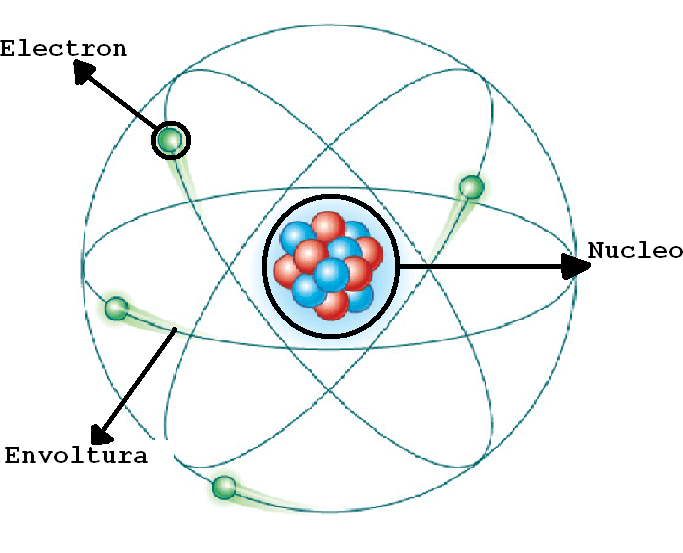
Rutherford, con estos resultados, planteó un nuevo modelo atómico. El átomo cuaba formado por un núcleo diminuto de elevada densidad másica, con carga eléctrica positiva debido a que, en él, se hallaban concentraban los protones. El resto del volumen atómico estaba vacío, lo cual explicaba que la inmensa mayoría de partículas lo atravesaran sin sufrir apenas desviación. Sólo se desviaban fuertemente las partículas que pasaban cerca del núcleo, debido a las fuerzas de repulsión entre cargas del mismo signo. En la superficie del átomo (corteza), los electrones giran alrededor del núcleo, de forma semejante a como lo hacen los planetas en torno al Sol.
Rutherford, estudiando la desviación que experimentaban las partículas α, llegó a determinar un diámetro para el átomo de 10-10m, al que le correspondía un diámetro nuclear de 10-15 m. El diámetro del átomo era unas 100 000 veces mayor que el de su núcleo. Si el núcleo de un átomo tuviera las dimensiones de una pelota de tenis, el átomo completo tendría un diámetro de unos 6 km. Al ser tan pequeño el volumen nuclear, su densidad resulta enormemente grande: 1014 veces la del agua. Si ésta tuviera la misma densidad que el núcleo atómico, a un litro de agua le correspondería una masa de cien mil millones de toneladas.
Sin embargo, este modelo no explicaba, por ejemplo, que el helio, que posee dos protones en el núcleo y dos electrones en la corteza, tuviera una masa atómica cuatro veces mayor que la del protón. Rutherford supuso que debían existir dos protones y dos electrones adicional. en el núcleo.
Estudios relativos a los espectros de rayos X realizados en 1913 por Moseley hicieron pensar que, en el núcleo, además de hallarse los protones, debían de existir unas partículas sin carga y con masa semejante a la del protón. Estas sospechas se confirmaron al descubrir Chadwick, en 1932, el neutrón. Al número de protones nucleares se le llama número atómico (Z) y coincide con el de electrones corticales en el átomo neutro. La suma del número de protones y neutrones (nucleones) se llama número masico (A).
¡Si te gustó el artículo no dudes en dejar tu comentario y/o todas tus consultas aquí abajo!
Si quieres conocer otros artículos parecidos a Estructura atómica: el núcleo puedes visitar la categoría Quimica.


Deja un comentario