Estructura atómica: la corteza (parte dos)
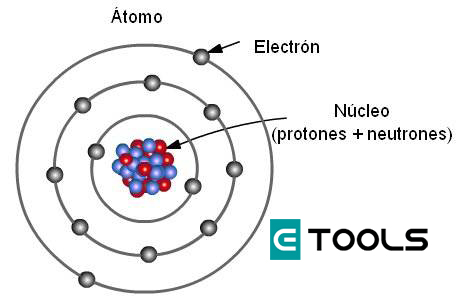
En el artículo anterior “Estructura atómica: la corteza” vimos la introducción al tema. A continuación, profundizaremos más sobre el mismo.
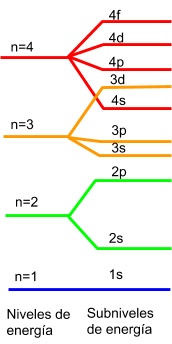
En 1925 el físico austríaco nacionalizado norteamericano Wolfgang Pauli (1990 – 1958). Discípulo de Sommerfeld, y posteriormente de Bohr, planteó la necesidad de establecer un cuarto número cuántico que se podía interpretar suponiendo que en cada subnivel energético podrían existir únicamente dos electrones, uno girando en la dirección de las agujas del reloj y el otro en sentido contrario. Con ello, en cualquier átomo, no podrían existir dos electrones con los cuatro números cuánticos iguales (principio de exclusión de Pauli). Admitiendo esta idea, era posible situar los electrones de los distintos elementos en niveles y subniveles. Si se considera que las propiedades químicas de los elementos son función de los electrones del nivel mas externo, quedaba justificado el sistema periódico de los elementos. Los de la primera columna se caracterizarían por tener un solo electrón en la ultima capa, los de la segunda dos, etc.
Poco tiempo después, los físicos neerlandonorteamericanos Goudsmit y Uhlenbeck observaron que las rayas espectrales de los metales alcalinos eran dobles, al obtener los espectros correspondientes mediante un espectroscopio de alta resolución. Este fenómeno se explica suponiendo que el electrón gira sobre sí mismo, además de girar alrededor del núcleo, comportándose como un pequeño imán cuyo campo magnético puede tener un sentido igual al opuesto al creado en el movimiento de traslación. En lugar de un solo nivel de energía, existen dos muy próximos. Se confirmaba la existencia del cuarto numero cuántico, que se llamo spin (giro). Demostraron, además, que la unidad de giro del electrón era la mitad de una unidad cuántica. Cada electrón posee un giro de +1/2 o -1/2.
Teoría de De Broglie
La luz puede considerarse de naturaleza ondulatoria, con lo que se pueden explicar los fenómenos de la difracción, interferencias, etc., y también puede interpretarse como de naturaleza corpuscular, lo cual justifica la radiación del cuerpo negro, el efecto fotoeléctrico, etc. En realidad, cometemos un error al intentar clasificar la luz en una u otra categoría, pues pertenece a las dos simultáneamente. Estos dos aspectos son complementarios, por lo que debemos admitir una naturaleza dual onda-partícula. Cometeríamos la misma equivocación si tratáramos de catalogar a un alumno atlético en estudiante o deportista; obviamente se pueden explicar sus buenas calificaciones de química teniendo en cuenta que es estudiante, y sus éxitos en atletismo considerando que es un deportista.
En 1924, el físico francés Louis-Victor De Broglie, basándose en la naturaleza onda-corpúsculo para la luz, sugirió que al ser sorprendentemente simétrica la naturaleza, la materia también debería tener esta dualidad. Estableció la hipótesis de que toda partícula material en movimiento tenía una onda asociada, a la que llamó onda de materia, cuya longitud tendría la misma ecuación aplicable a la luz. Dos años más tarde, los físicos Clinton Joseph Davisson y George Paget Thomson, hijo de J.J. Thomson, demostraron que las láminas metálicas difractaban los electrones exactamente igual que difractan un haz de rayos X, y que la longitud de onda de un haz de electrones cumple la ecuación propuesta por De Broglie. La dualidad onda-corpúsculo es general para todos los cuerpos, aunque para los que poseen un tamaño mucho mayor que las partículas subatómicas resulta despreciable el comportamiento ondulatorio.
Principio de incertidumbre de Heisenberg
El físico alemán Karl Werner Heisenberg pensaba que, en lugar de tratar de explicar las líneas espectrales mediante un modelo visual del átomo, que tantos problemas ocasionaba, era mejor idear una relación matemática que las justificara. Utilizó un sistema matemático al que llamarla mecánica matricial. En 1927, sus cálculos le llevaron a establecer el principio de incertidumbre que lleva su nombre: es imposible realizar una determinación caca de la posición y del momento lineal (masa x velocidad) de una partícula con absoluta certeza. Como un electrón cribe órbitas complicadas alrededor del núcleo y resulta imposible determinar tanto su momento como su posición, cabe pensar solamente en la probabilidad de encontrar el electrón en una posición determinada.
Modelo atómico de Schrödinger
En 1926, el físico austríaco Erwin Schrödinger (1887-1961) llegó a los mismos resultados obtenidos por Heisenberg con la mecánica matricial, pero consiguiendo un modelo atómico más visual.
Modificó el modelo de Bohr introduciendo las propiedades ondulatorias que posee el electrón. Con esta idea comprendió que el electrón no vulneraba las leyes de Maxwell y obtuvo una ecuación matemática, ecuación de onda, en la que las órbitas planetarias —imposibles de determinar según Heisenberg— se sustituyen por zonas del espacio, alrededor del núcleo, donde es mayor la probabilidad de encontrar un electrón en un determinado subnivel (orbitales atómicos).
¡Si te gustó el artículo no dude en dejar tu comentario aquí abajo!
Si quieres conocer otros artículos parecidos a Estructura atómica: la corteza (parte dos) puedes visitar la categoría Quimica.



Deja un comentario